Για να εκτυπώσετε το Θέμα πατήστε "Εκτύπωση"!
Έναρξη από 2 Σεπτεμβρίου
| Τύπος Σχολείου: | Γενικό Λύκειο | Πηγή: Ι.Ε.Π. | Αναγνώσθηκε: 6123 φορές Επικοινωνία | |
|---|---|---|---|---|
| Μάθημα: | Χημεία | Τάξη: | Γ' Λυκείου | |
| Κωδικός Θέματος: | 24175 | Θέμα: | 2 | |
| Τελευταία Ενημέρωση: | 11-Μαρ-2023 | Ύλη: | 4.2 Παράγοντες που επηρεάζουν τη θέση χημικής ισορροπίας - Αρχή Le Chatelier 4.3 Σταθερά χημικής ισορροπίας Kc - Kp 6.2 Αρχές δόμησης πολυηλεκτρονικών ατόμων 6.3 Δομή περιοδικού πίνακα (τομείς s,p,d,f) - Στοιχεία μετάπτωσης 7.1 Δομή οργανικών ενώσεων - Διπλός & τριπλός δεσμός - Επαγωγικό φαινόμενο 7.3 Κατηγορίες οργανικών αντιδράσεων & μερικοί μηχανισμοί οργανικών αντιδράσεων | |
| Το θέμα προέρχεται και αντλήθηκε από την πλατφόρμα της Τράπεζας Θεμάτων Διαβαθμισμένης Δυσκολίας που αναπτύχθηκε (MIS5070818-Tράπεζα θεμάτων Διαβαθμισμένης Δυσκολίας για τη Δευτεροβάθμια Εκπαίδευση, Γενικό Λύκειο-ΕΠΑΛ) και είναι διαδικτυακά στο δικτυακό τόπο του Ινστιτούτου Εκπαιδευτικής Πολιτικής (Ι.Ε.Π.) στη διεύθυνση (http://iep.edu.gr/el/trapeza-thematon-arxiki-selida) | ||||
| Τύπος Σχολείου: | Γενικό Λύκειο | ||
|---|---|---|---|
| Τάξη: | Γ' Λυκείου | ||
| Μάθημα: | Χημεία | ||
| Θέμα: | 2 | ||
| Κωδικός Θέματος: | 24175 | ||
| Ύλη: | 4.2 Παράγοντες που επηρεάζουν τη θέση χημικής ισορροπίας - Αρχή Le Chatelier 4.3 Σταθερά χημικής ισορροπίας Kc - Kp 6.2 Αρχές δόμησης πολυηλεκτρονικών ατόμων 6.3 Δομή περιοδικού πίνακα (τομείς s,p,d,f) - Στοιχεία μετάπτωσης 7.1 Δομή οργανικών ενώσεων - Διπλός & τριπλός δεσμός - Επαγωγικό φαινόμενο 7.3 Κατηγορίες οργανικών αντιδράσεων & μερικοί μηχανισμοί οργανικών αντιδράσεων | ||
| Τελευταία Ενημέρωση: 11-Μαρ-2023 | |||
| Το θέμα προέρχεται και αντλήθηκε από την πλατφόρμα της Τράπεζας Θεμάτων Διαβαθμισμένης Δυσκολίας που αναπτύχθηκε (MIS5070818-Tράπεζα θεμάτων Διαβαθμισμένης Δυσκολίας για τη Δευτεροβάθμια Εκπαίδευση, Γενικό Λύκειο-ΕΠΑΛ) και είναι διαδικτυακά στο δικτυακό τόπο του Ινστιτούτου Εκπαιδευτικής Πολιτικής (Ι.Ε.Π.) στη διεύθυνση (http://iep.edu.gr/el/trapeza-thematon-arxiki-selida) | |||
Θέμα 2ο
Ένα από τα πιο σημαντικά παράγωγα του πετρελαίου είναι το αιθένιο \((CH_{2}=CH_{2})\).Αποτελεί πρώτη ύλη για τησύνθεση εκατοντάδων διαφορετικών προϊόντων που χρησιμοποιούνται καθημερινά, για παράδειγμα πλαστικές σακούλες, πλαστικές μεμβράνες και πλαστικές φιάλες από πολυαιθυλένιο.
α) Αν γνωρίζετε ότι ο ατομικός αριθμός του άνθρακα είναι \(Ζ=6\):
i. Να προσδιορίσετε σε ποια περίοδο, ποια ομάδα καισε ποιον τομέα του Περιοδικού Πίνακα ταξινομείται το στοιχείο άνθρακας. ( μονάδες 3 )
ii. Να επιλέξετε μεταξύ των τριών παρακάτω τύπωναυτόν που απεικονίζει ορθότερα το μόριο του αιθενίουστον χώρο και αφού τον αντιγράψετε στο γραπτό σας, να σημειώσετε τους σ-δεσμούς και τους π-δεσμούς που υπάρχουν στο αιθένιο. ( μονάδες 2 )
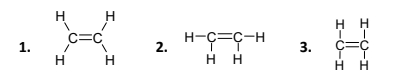
iii. Να αναφέρετε τα ατομικά ή/και υβριδικά τροχιακά που επικαλύπτονται σε κάθε έναν από τους ομοιοπολικούς δεσμούς στο μόριο του αιθενίου. ( μονάδες 3 )
β) Το αέριο αιθένιο αντιδρά με υδρατμούς και παράγεται αιθανόλη σύμφωνα με τη χημική αντίδραση που περιγράφεται με τη θερμοχημική εξίσωση (1):
\(CH_{2}=CH_{2}(g)+H_{2}O(g)\) ⇌ \(CH_{3}CH_{2}OH(g), ΔΗ = -45 kJ/mol\ \ \ (1)\)
i. Να γράψετε την έκφραση και τις μονάδες της σταθεράς \(K_{c}\) για την παραπάνω χημική ισορροπία. ( μονάδες 3)
ii. Να ερμηνεύσετε την επίδραση που θα έχει στη θέση της χημικής ισορροπίας η αύξηση της θερμοκρασίας πραγματοποίησης της αντίδρασης. (μονάδες 5)
iii. Να εξηγήσετε με ποιον τρόπο μεταβάλλεται η τιμή της \(K_{c}\) της χημικής ισορροπίας αν αυξηθεί η θερμοκρασία πραγματοποίησης της αντίδρασης. ( μονάδες 4)
γ ) Σε κατάλληλες συνθήκες το αιθένιο μπορεί να πολυμεριστεί.
i. Να γράψετε την αντίδραση του πολυμερισμού του αιθένιου. (μονάδες 3)
ii. Να εξηγήσετε αν το προϊόν της αντίδρασης πολυμερισμού του αιθένιου μπορεί να αποχρωματίσει κόκκινο διάλυμα βρωμίου σε τετραχλωράνθρακα \((Br_{2}/CCl_{4})\). ( μονάδες 2 )
Μονάδες 25
Ενδεικτικές απαντήσεις
α)
i. Η ηλεκτρονιακή κατανομή σε υποστιβάδες για το στοιχείο \(6C\) θα είναι: \(1s^{2}2s^{2}2p^{2}\).
Στα άτομα του στοιχείου άνθρακας (C) τα ηλεκτρόνια κατανέμονται σε δύο στιβάδες επομένως το στοιχείο ταξινομείται στη δεύτερη περίοδο του Περιοδικού Πίνακα. Επιπλέον το άτομο του στοιχείου άνθρακας στην εξωτερική του στιβάδα διαθέτει τέσσερα \((4)\) ηλεκτρόνια επομένως ανήκει στην \(14^{η}\) ή IVAή \(p^{2}\) ομάδα του Περιοδικού Πίνακα. Το τελευταίο ηλεκτρόνιο (με τη μεγαλύτερη ενέργεια) του άνθρακα τοποθετείται σε υποστιβάδα τύπου \(p\),επομένως ο άνθρακας ταξινομείται στον τομέα p του Περιοδικού Πίνακα.
ii. Ο τύπος που αποδίδει που απεικονίζει ορθότερα το μόριο του αιθενίου στον χώρο είναι ο τύπος 1. Στο αιθένιο υπάρχουν πέντε (5) ομοιοπολικοί σ-δεσμοί και ένας ομοιοπολικός π-δεσμός που σημειώνονται στο σχήμα που ακολουθεί:
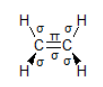
iii. Οι τέσσερις ομοιοπολικοί \(σ-δεσμοί\) σχηματίζονται μεταξύ άνθρακα και υδρογόνου και τα τροχιακά που επικαλύπτονται σε κάθε περίπτωση είναι ένα υβριδικό τροχιακό \(sp^{2}\) του άνθρακα και το \(s\) ατομικό τροχιακό του ατόμου του υδρογόνου (οι ομοιοπολικοί δεσμοί είναι τύπου \(sp^{2}-s\) ). Ο πέμπτος ομοιοπολικός σ-δεσμός προκύπτει με την επικάλυψη ενός \(sp 2\) υβριδικού ατομικού τροχιακού από κάθε ένα άτομο άνθρακα (ομοιοπολικός δεσμός τύπου \(sp^{2} - sp^{2}\) ). Ο π-δεσμός προκύπτει με πλευρική επικάλυψη ατομικών τροχιακών \(2 p\) κάθε ατόμου άνθρακα.
β )
i. Η έκφραση της \(K\) cείναι:
\(K_{c}=\dfrac{[CH_{3}CH_{2}OH]}{[CH_{2}=CH_{2}][H_{2}O_{}]}\)
Επομένως για τις μονάδες θα ισχύει: \(\dfrac{\dfrac{mol}{L}}{\dfrac{mol}{L}\cdot \dfrac{mol}{L}}\) = \(\dfrac{L}{mol}\)
i i. Η αντίδραση σύνθεσης της αιθανόλης είναι εξώθερμη. Επομένως σύμφωνα με την αρχή Le Chatelier, η αύξηση της θερμοκρασίας θα οδηγήσει τη θέση χημικής ισορροπίας προς την κατεύθυνση όπου τείνει να αναιρέσει την αύξηση της θερμοκρασίας, άρα προς την ενδόθερμη πλευρά, επομένως η θέση της χημικής ισορροπίας θα μετατοπιστεί προς τα αριστερά.
iii. Η τιμή της \(K_{c}\) μεταβάλλεται όταν αλλάζει η θερμοκρασία πραγματοποίησης της χημικής αντίδρασης. Με την αύξηση της θερμοκρασίας η θέση της χημικής ισορροπίας (1) μετατοπίζεται προς τα αριστερά. Επομένως ο αριθμητής στη σταθερά της χημικής ισορροπίας (1) ελαττώνεται ενώ ο παρονομαστής αυξάνεται. Άρα η τιμή της \(K_{c}\) της χημικής ισορροπίας (1) ελαττώνεται όταν αυξηθεί η θερμοκρασία πραγματοποίησης της χημικής αντίδρασης.
γ )
i. Ο πολυμερισμός του αιθενίου περιγράφεται με τη χημική εξίσωση: \(v( CH_{2}=CH_{2} ) \rightarrow ( -CH_{2}-CH_{2}- )v\)
ii. Το προϊόν της αντίδρασης πολυμερισμού του αιθένιου (πολυαιθυλένιο, όπως φαίνεται στην αντίδραση πολυμερισμού) δεν διαθέτει πολλαπλούς δεσμούς μεταξύ των ατόμων άνθρακα και επομένως δεν αποχρωματίζει το κόκκινο διάλυμα βρωμίου στον τετραχλωράνθρακα.
